GS1 China 中国物品编码中心是国家药监局指定发码机构,官方发码,UDI编码赋码合规无忧!
企业开通GS1 UDI服务平台,可实现在一个平台完成从厂商识别代码申请、UDI编码、备案至中国商品信息服务平台及药监局数据库、信息管理、标签设计、打印喷码等UDI实施全流程。
目前已实施UDI的医械企业,90%以上采用GS1码制,如果你的企业也遇到UDI实施问题,如果你的企业也遇到UDI实施问题可以看下图,了解GS1一站式UDI服务。
一、UDI法规基础介绍
中国UDI的“基本法”是《医疗器械唯一标识系统规则》,这个规则是2019年8月发布的。其基本目的是为了贯彻落实《国务院办公厅关于印发治理高值医用耗材改革方案的通知》(国办发〔2019〕37号),规范医疗器械唯一标识系统建设,加强医疗器械全生命周期管理。
首先回顾一下中国医疗器械UDI实施的一些关键时间点:
2019年7月 ——【药监综械注〔2019〕56号】 关于印发医疗器械唯一标识系统试点工作方案的通知: 拉开了中国UDI的序幕 ;
2019年8月 ——【2019年第66号】国家药监局关于发布医疗器械唯一标识系统规则的公告: 中国UDI的规则被正式建立 ;
2019年10月 ——【2019年第72号】国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告:明确了第一批实施产品及其时间点;
2019年12月 —— UDI数据库正式上线 ;
2020年9月 ——【2020年第106号】关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告: 第一批实施产品时间点推迟到2021年1月1日 。
二、什么是UDI?
唯一器械标识(Unique Device Identification,缩写UDI), 医疗器械唯一标识是指呈现在医疗器械产品或者包装上的由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
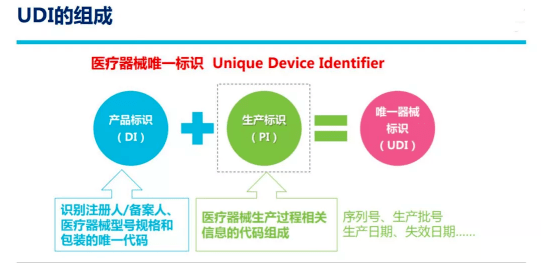
UDI可以被看作医疗器械产品在供应链中的唯一“身份证”, 应包括产品标识和生产标识。产品标识为识别注册人/备案人、医疗器械型号规格和包装的唯一代码;生产标识由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。
三、什么是UDI数据载体?
UDI数据载体 ,是 指存储或者传输医疗器械唯一标识的数据媒介 , 其应当满足自动识别和数据采集技术以及人工识读的要求,通俗来说就要包括两部分:一部分是 机器可读 ,其形式可以为 一维码、二维码或者射频标签 ;另外一部分是 人工可读 ,即应为数字和/或字母的形式。
四、什么是UDI数据库?
UDI数据库 ,是 指储存 医疗器械唯一标识的 产品标识 与 关联信息 的 数据库 。与美国的GUDID系统和欧盟的UDI数据库类似,该数据库对公众开放,供公众查询。药监局负责建立及维护该数据库; 注册人 /备案人 应在产品上市销售前,将产品标识(DI)及相关数据上传至该数据库 ,并 维护更新相关数据 。
五、发码机构是什么?中国有哪些认可的发码机构?
器械唯一标识的发码机构应当为 中国境内的法人机构 ,具备完善的管理制度和运行体系,确保按照其标准创建的医疗器械唯一标识的唯一性,并符合我国数据安全有关要求。
发码机构应当向注册人/备案人提供执行其标准的流程并指导实施,为便于注册人/备案人等掌握发码机构的编码标准,供相关方选择或应用,发码机构应当将其编码标准上传至医疗器械唯一标识数据库并动态维护。
目前中国认可的发码机构有三家:
六、UDI实施准备
熟悉UDI的基本法《规则》、持续跟踪UDI的相关法规:
就目前来说,监管部门只公布了第一批UDI实施目录和实施时间,当前目录中涵盖的是III类高风险器械,包括:有源手术器械、无源手术器械、神经和心血管手术器械、医用成像器械、输血、透析和体外循环器械、有源植入器械、无源植入器械、注输、护理和防护器械、眼科器械等共9大类产品,具体产品类别见国家药监局/国家卫生健康委/国家医保局公告(2020年 第106号),实施时间为2021年1月1日。
熟悉UDI相关标准:
与UDI相关的标准,主要包括:
选择合适的发码机构:
如果只考虑中国市场,我们可以选择前文中三家发码机构中的任何一家。但由于不少器械的销售市场不仅仅局限于国内。在这种情况下,我们发码机构的选择就要兼顾到海外监管部门的要求(美国、欧盟)。
下表是目前欧盟和美国监管部门认可的发码机构。
由此我们可以看出,只有GS1一家机构能同时满足中国、欧盟和美国的要求。(下文如果没有特别说明,就以GS1来举例)
申请注册人备案人识别代码
注册人备案人识别代码通常有7~10位数字组成,这个代码可追溯到某个特定注册人备案人。注册人备案人代码前三位是前缀码,国际物品编码协会已经分配给中国GS1的前缀码为690-699。我们在申请的时候可以参考GS1的官网,在GS1的官网上面给了比较清楚的步骤,如下:
确定UDI的组成:
我们之前已经了解到:医疗器械唯一标识包括产品标识和生产标识, 即UDI=产品标识(DI)+生产标识(PI)。
UDI的结构示意图如下(摘自YY/T 1630-2018 附录A):
上面的产品标识和生产标示只是一个示意图,DI和PI可以是串联,也可以并联的。下面是两个不同厂家的UDI示例,供参考。
UDI规则和GS1的标准的对应关系如下:
产品标识UDI-DI:
UDI-DI是一个静态信息,用来指明供应链中某个医疗器械的身份信息。在中国,GB 12904中规定了商品条码即GTIN的表示方法。对于医疗器械,最常见的表示方法为GTIN-14,下面我们就以GTIN-14来举例:
上图GTIN-14的第一位(D1)为指示位(indicator),用来指示不同的包装等级;剩下的第2到第13位(D2 - D13)分别包括注册人备案人识别代码、商品项目代码;最后一位(D14)为校验码。
注册人备案人 识别代码 由7-10位数字组成,由中国编码中心负责分配和管理。注册人备案人识别的前3位为前缀码,前缀码由国际物品编码协会分配给中国。
商品代码由5-2位数字组成,一般注册人备案人可自行编制。
校验码有1位数字,用于检验整个编码的正误。校验码可以自行计算,其方法可以参考标准GB12904-2008的附录B。从实操角度来说,目前很多编码软件能自动计算产生。
生产标识 UDI-PI:
UDI-PI对应于GS1标准来讲即为应用标识符。它是一个动态信息,其内容通常为序列号、批号、生产日期和有效期(失效日期)等;它属于某个特定医疗器械的动态附加信息,可以跟踪到具体的产品或者批次。
根据《GB/T 16986-2018 商品条码 应用标识符 》,应用标识符常见格式如下:
建议医疗器械厂家根据自己的实际情况(以满足追溯的要求)来确定产品的生产标识信息。例如:
1、对于要求追溯到批次的器械,由DI联合PI中的生产日期/有效期、批号实现。
2、对于要求追溯到单品的医疗器械,由DI联合PI中的生产日期/有效期、序列号实现。
七、UDI标签生成
在产品完成GTIN(UDI-DI)分配,同时确定了产品的生产标识 UDI-PI后,下一步的动作就是生成UDI标签。按照中国法规的要求,UDI应包括两个部分:
(1)机器可读码,目前最为常见的形式就是一维码和(或)二维码。(注册人备案人可以根据自己的产品实际情况选择合适的UDI载体)。
(2)人工可读,即为数字和字母组合。
怎么产生一维码、二维码?现在市面上有很多现成软件能自动产生一维码、二维码,也有很多这方面的厂家提供服务,可以基于自己的实际情况去选择适合自己的方法。
在生成完一维码、二维码后,注册人备案人需要对现有标签进行标签变更。之后就可以完成UDI标签打印及UDI标签的检验,标签检验的目的就是保证UDI可以在整个流通领域的可读性。
在完成上面的动作后,我们是否就能满足中国UDI的要求?是否就能把UDI标签贴在产品上去上市流通了呢?当然不是。
八、UDI数据上传
产品要上市流通,还要完成下面的环节 :
(1)注册人备案人应当 在申请医疗器械注册 、 注册变更或者办理备案时 , 在注册/备案管理系统中提交其产品标识 (UDI-DI)。注意:产品在UDI实施日前,已生产销售的医疗器械可不具备医疗器械唯一(UDI)标识。
(2)注册人备案人在销售产品之前 ,应确保产品标识和相关数据上传至中国医疗器械唯一标识数据库(UDID) 。 同样的这也是针对已经实施UDI的产品,对尚未列入实施目录的产品不强制要求。
相关数据是什么 ?相关数据包括哪些内容?请参考标准《YY/T 1752-2020 医疗器械唯一标识数据库基本数据集》。里面对于每个数据集都有相关的解释。
怎么填报呢 ?请参考标准《YY/T 1753-2020 医疗器械唯一标识数据库填报指南》。具体操作可以通过国家药品监督管理局网上办事大厅实现系统登录操作。
完成以上的动作,可以认为该医疗器械已经能满足中国UDI的最基本要求。
最后,建议注册人备案人 建立相关的程序文件来确保整个过程是是受控的 、 可持续的,使UDI管理过程规范化、制度化。
01
UDI是什么?
UDI(Unique Device Identification)又叫医疗器械唯一标识,是一串由符号、数字或者字母组成的代码,一般附着在医疗器械产品和包装上。它是医疗器械唯一标识系统中最重要的一环,具备全球唯一性,可用于医疗器械产品的精准识别,便于监管和追溯,所以也被称为医疗器械产品的“数字身份证”。
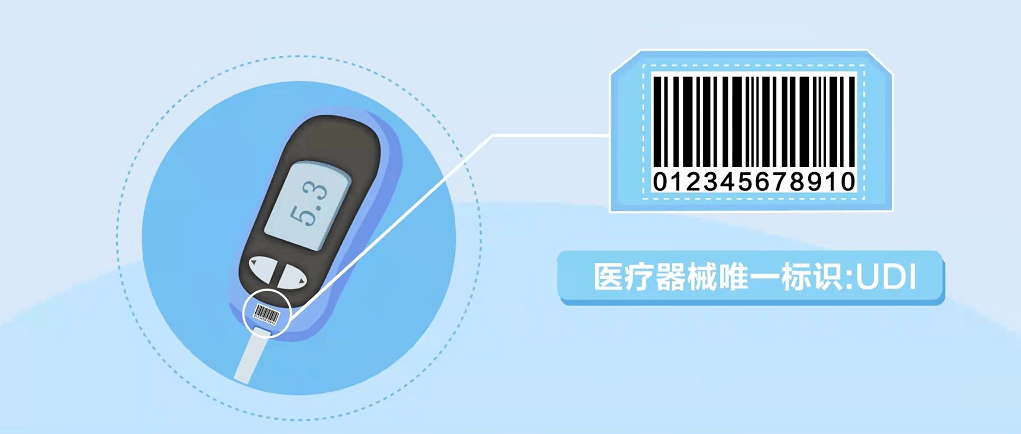
UDI存在于医疗器械产品生产、流通、使用的整个生命周期中,是精准识别医疗器械信息的基础。由产品标识(DI)和生产标识(PI)两部分组成。DI是产品静态信息,包括企业编码和产品ID。其中,企业编码由备案人申请,由符合我国医疗器械编码规则和标准的发码机构发出的,是具备唯一性的编码;产品ID是一段包含具体产品名称、包装等级、规格型号的编码。PI是产品动态信息,包括生产日期、失效日期、生产批次、序列号、校检位等。目前,PI编码暂不需要上传到药监局数据库,各使用单位可采用扫描设备直接获取产品相关生产信息。
数据载体、UDI和数据库共同组成了UDI系统,它可以提高医疗器械不良事件报告的质量,更有效地识别产品问题,更迅速地召回问题器械,以确保患者的安全。

推行UDI的过程
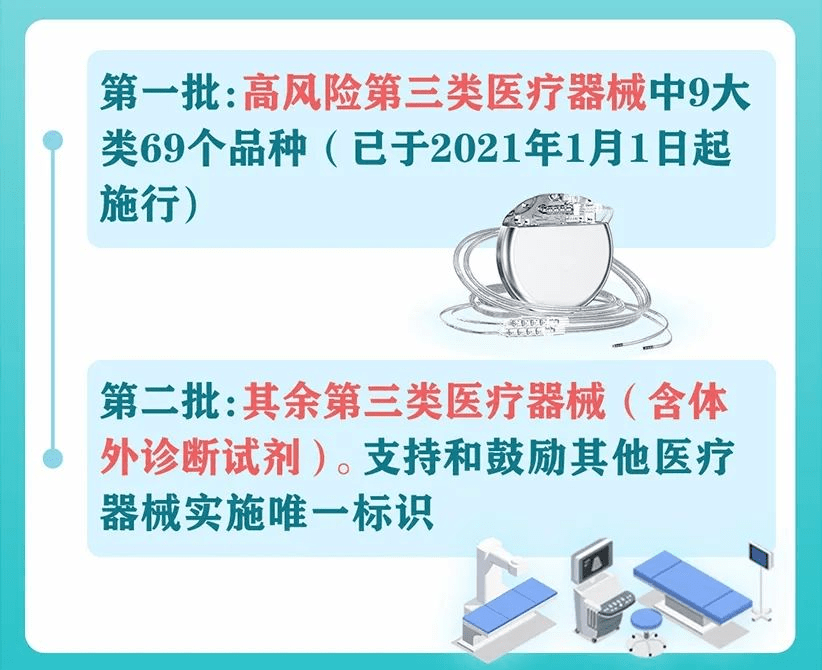
早在1999年开始,UDI相继在美国、欧盟和日本等国家和地区得到了积极推进。而我国,于2021年1月1日起,高风险第三类医疗器械中9大类69个品种作为第一批开始施行,其余第三类医疗器械(含体外诊断试剂),支持和鼓励其他医疗器械实施唯一标识。到今年6月1日起,医疗器械就全面进入UDI时代了。距离明确的时间节点,已经迫在眉睫。

02
推行UDI有什么意义?
UDI存在于医疗器械产品生产、流通、使用的整个生命周期中,是精准识别医疗器械信息的基础。
01
对于企业来说
建立UDI系统有助于提升企业信息化管理水平,建立产品追溯体系,提升企业管理效能,助推医疗器械产业高质量发展。
02
对于流通机构来说
建立UDI系统有助于流通企业建立现代化物流体系,实现医疗器械供应链的透明化、可视化、智能化。
03
对于医疗机构来说
建立UDI系统有助于加强医疗器械在临床使用环节的风险管控,降低器械使用差错,保障患者用械安全;
04
对于监管部门来说
建立UDI系统有助于医疗器械监管部门构建器械监管大数据,实现对医疗器械来源可查、去向可追,责任可究,实现智慧监管。
05
对于社会相关部门来说
建立UDI系统有助于提升卫生、医保、海关等部门,对于医疗器械临床使用、招标采购、医保结算,进口通关等环节的管理效率;
06
对于广大用械者来说
有助于放心用械、明白消费。
UDI系统将推动实现医疗器械智慧监管与社会共治,助力产业转型升级和健康发展,为公众提供更加安全高效的医疗服务,增强人民群众的获得感、幸福感和安全感。

03
UDI如何实施落地?
法治理念根植于一定社会的经济、政治、文化等诸方面必然性要求之中,它是法治的灵魂,体现了法治的精神实质和价值追求,所要解决的是为什么实行法治以及如何实现法治的问题。
无论是政策,还是从施行的意义上,建立UDI系统已成为每个医疗器械企业必须完成的事项。那么如何开展相关工作,迅速落地实施呢?
01
申请厂商识别代码
企业需到中国物品编码中心申请9位厂商识别代码。
02
绑定UDI管理系统及授权
企业需到国家药品监督管理总局申请绑定“医疗器械唯一标识管理系统”,并授权第三方编码机构作为产品唯一标识数据接口。
03
UDI编码、赋码
开通第三方编码机构后,录入DI和PI信息,建立专属UDI系统。
然而,在真正落地执行的过程中,不少器械企业却遇到了诸多困难,如:
(1)UDI编码规则到底是什么?怎样才能合法合规?
(2)已有的生产线是否需要更换生产设备?花费成本大吗?
(3)识别设备系统不兼容,维护困难
……
研发设计医疗器械如此艰巨的任务都已完成,难不成要被这个小小的UDI阻难前进的步伐?放心,无限云溯作为提供医疗器械UDI系统一站式解决方案的提供商,拥有缜密的溯源系统,助力医疗器械企业一举抢占市场先机。
无限云溯累计发明专利及知识产权高达70多项,其中发明专利18项,软件著作权50余项。先后获得了“国家高新技术企业”、“双软企业”、并成功通过CMMI三级和ISO90012008质量管理体系认证。可以做到:
01
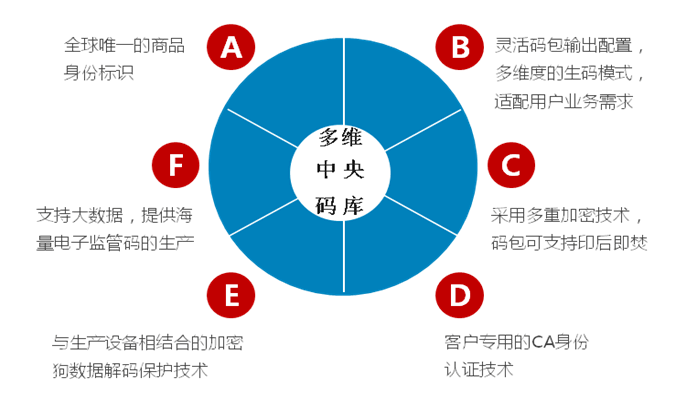
多维中央码库,满足医疗器械全场景赋码需求
可以通过无限云溯系统的灵活配置,生成多维度组合方式的一物一码的具有电子监管码特性的数据码包,并应用到智能包装印刷或是电子标签(RFID)的赋码环节,以满足不同应用场景的企业生码和赋码的需求。
多维度既包括单一的电子监管码的生成,也包括电子监管码+验证码、电子监管码+验证码+序列号的组合方式,还支持多层级具有包装关联属性的套标码的生成,以及具有图形视觉效果的二维码的生成等电子监管码的输出方式,多维度的满足医疗器械企业的赋码需求,基于商品的数字包装、智能包装、电子标签的感知标识的实现。
02
全环节信息采集,保障信息真实有效
提供移动设备PDA的标准化产品,通过业务日常操作,完成器械信息数据的采集。可支持器械的生产数据采集、品质信息采集、出入库信息采集、零售终端信息采集和消费者的行为数据采集,通过器械的包装印刷、生产、流通、零售等作业环节的数据采集,收集企业的大数据,为后续各类应用提供原始数据支撑。
通过作业环节的数据采集,用户可以很灵活的选择电子监管码的激活,确保被激活的电子监管码是真实有效,避免了码值有效性的外泄风险。

03
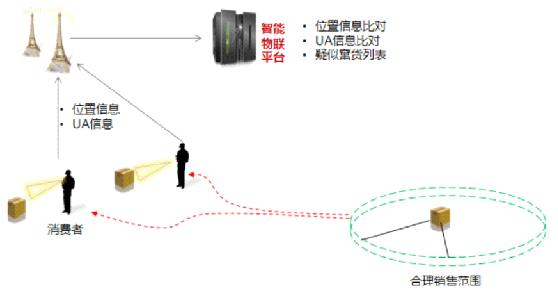
全方位追踪信息,防止医疗器械窜货
为管理市场秩序和产品质量,防止产品乱价,企业往往需要通过追踪了解产品在各个区域销售状态,加强对产品数据管理,监督每批产品去向,完成窜货预防。
无限云溯可依据多维中央码库的生码,在经销商、用械者扫码过程时,系统将实时采集地理位置信息,将采集到的地理信息与商品分拣时关联的经销商销售区域信息进行对比,实施窜货监控及预警,让防窜货稽查工作有的放矢。
04
数据共创共享,提供可靠信息
通过建立起来的信息系统,把采集到的UDI数据,通过多种方式将数据共享给经营企业、医疗机构、政府相关部门及社会公众。为相关部门的监管、追溯、预警、召回、企业的投资、经营管理提供可靠数据依据。

医疗器械UDI,作为解决医疗器械全球监管问题的通用语言、国际语言和专业语言,是实现我国医疗器械全球化、信息化数字化产业发展的必然之路,是提高监管和社会治理能力的有效手段,更是中国器械走向世界的现实要求。





